Escaso control de medicamentos (I): El riesgo que corren los pacientes de hospitales
17.10.2008
Hoy nuestra principal fuente de financiamiento son nuestros socios. ¡ÚNETE a la Comunidad +CIPER!
17.10.2008

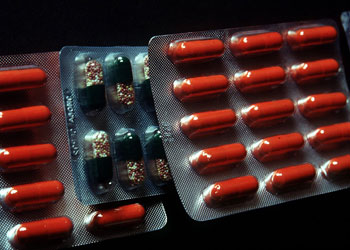
Sólo el 19,1% de los medicamentos consumidos en Chile son «originales» fabricados por el laboratorio que los patentó, mientras que el 36,2% son genéricos o «copias», en muchos casos más baratas. Pero los efectos no son los mismos: médicos y funcionarios de hospitales aseguran que fármacos genéricos vitales -como los que se usan para dormir a los pacientes en una operación- tardan demasiado en hacer efecto o simplemente no funcionan. Incluso hay cardiólogos que sencillamente no operan si les proveen de «copias» de anticoagulantes. Pese al enorme consumo e importación de genéricos, en el país aún no son obligatorios los exámenes que prueben que dos drogas con los mismos compuestos se comporten de idéntica forma.
El 12 de octubre de 2003, Juan Esteban Mendoza compró un antibiótico llamado Metronidazol. Y en el interior del envase, Mendoza no sólo encontró las píldoras que le habían recetado: también descubrió un insecto que no supo identificar. El sumario iniciado tras su denuncia tardó tres años en concluir. El laboratorio responsable era BestPharma, que ya entonces acumulaba decenas de multas de distinta gravedad. La más alarmante se originó cuatro años más tarde, cuando se detectó que uno de los medicamentos de BestPharma para tratar el cáncer de mama -Tamoxifeno-, no tenía efecto.
Meses después, el Instituto de Salud Pública (ISP) decretó la clausura del Laboratorio BestPharma, luego que éste sumara 56 sumarios sanitarios. La medida encendió la primera alerta seria sobre la calidad de los fármacos que los chilenos consumen a diario.
«La única diferencia entre el medicamento y el veneno es la dosis», advierte el presidente del Colegio de Químico Farmacéutico, Elmer Torres. Y no es el único riesgo: ante la ceguera total de quien no sabe qué contiene la píldora que ingiere o la inyección o el suero que le están aplicando, es posible utilizar una droga no más potente que un caramelo, confiando inocentemente en su efecto terapéutico. Entre ambos peligrosos extremos, un mundo de posibilidades imposibles de detectar para un paciente común.
Tras la polémica pública por el cierre de BestPharma, la inquietud sobre la calidad de los medicamentos quedó instalada. La investigación realizada por CIPER comprobó otros hechos de mayor gravedad que requieren respuesta.
 Cuando los pacientes de la nueva unidad de endoscopía del Instituto del Cáncer empezaron a no dormirse o simplemente se sacaban los tubos en medio del procedimiento, los médicos sospecharon que algo andaba mal con el Midazolam, la droga usada para inducir el sueño.
Cuando los pacientes de la nueva unidad de endoscopía del Instituto del Cáncer empezaron a no dormirse o simplemente se sacaban los tubos en medio del procedimiento, los médicos sospecharon que algo andaba mal con el Midazolam, la droga usada para inducir el sueño.
En el vecino Hospital San José también había problemas con el Midazolam: de pronto empezaron a gastar más del doble de ampollas que utilizaban para sedar a los pacientes en ventilación mecánica. Una tercera señal se originó en el Hospital San Borja Arriarán al detectar que los tiempos de respuesta de sus enfermos para la mencionada droga se estaban alargando demasiado.
Fueron tantos los reclamos que, a fines del año pasado, en el Instituto del Cáncer se decidió someter el Midazolam a un estudio interno para verificar su eficacia. La jefa de Farmacia, Verónica Rabanal, informó a CIPER de los resultados: se analizaron 40 casos y constataron que «sobre el 60% de los pacientes el efecto no era el óptimo». Estaban usando copias del medicamento de referencia, o de la droga original de marca que patentó el laboratorio que lo creó.
El Hospital San José también hizo su propio estudio aplicando una escala que mide qué tan despiertos están los pacientes. «Se vio que era mucho más efectivo el Midazolam original, así es que nos cambiamos», dice la jefa de Farmacia, Elizabeth Romero. El cambio de marca trajo un efecto inmediato: «De 4.500 ampollas que yo compraba, pasé a 1.500», agrega Romero. Pero el triple de efectividad no fue suficiente, pues el medicamento innovador cuesta unas cuatro veces más que sus competidores. Por eso, ahora probarán con nuevas marcas.
En la unidad de cuidados intensivos del Hospital San Borja Arriarán hicieron un estudio similar con el Midazolam original y el que copió la marca. «Fue hace varios años, pero recuerdo que la diferencia en el tiempo de respuesta era bastante», dice la jefa de Farmacia, Angelina Oyarzún. Desde entonces, en la unidad de cuidados intensivos sólo usan el Midazolam original. «No podemos arriesgar nada con los casos críticos», explica Angelina.
El Midazolam es una benzodiazepina cuyo efecto es hipnótico y sirve para inducir a la anestesia. Como todas las drogas de su tipo, una dosis excesiva puede ser riesgosa, pero ninguno de los expertos consultados pudo decir con certeza si aumentar la dosis de un producto menos eficaz puede causar daños secundarios. Y todos insistieron en que primero es necesario saber exactamente por qué el fármaco no está siendo efectivo.
Lo anterior sólo será posible después de los análisis que está haciendo el Instituto de Salud Pública (ISP) sobre el Midazolam tras recibir denuncias de dos hospitales. La sorpresa fue descubrir que el procedimiento iniciado por el ISP no se originó en los reclamos y estudios de ninguno de los tres establecimientos hospitalarios antes nombrados, sino del Sótero del Río y el Gustavo Fricke. Ello habla de la magnitud del problema.
A fines del año pasado, el Instituto del Cáncer sometió el Midazolam – una benzodiazepina cuyo efecto es hipnótico y sirve para inducir a la anestesia- a un estudio interno para verificar su eficacia. La jefa de Farmacia, Verónica Rabanal, informa que se analizaron 40 casos y constataron que «sobre el 60% de los pacientes el efecto no era el óptimo». Estaban usando copias del medicamento de referencia, o de la droga original de marca que patentó el laboratorio que lo creó.
-En las drogas de síntesis química como el Midazolam, si dice 500 miligramos, tiene que actuar como tal, si no es así, quiere decir que, probablemente, o hay menos del principio activo -no los 500 miligramos que dice- o hay algún componente en la formulación que está inhibiendo la absorción o la acción farmacológica del producto -dice la directora del ISP, Ingrid Heitmann.
El método para comprobar la efectividad de una droga como el Midazolam ha sido relativamente fácil: el paciente se duerme o no. Pero determinar si otros medicamentos tienen problemas similares, no es posible. Así lo afirmaron a CIPER las jefas de farmacias del Instituto del Cáncer y de los hospitales San Borja Arriarán y San José. Y el temor es que otras drogas sean también poco efectivas y nadie pueda percibirlo a simple vista.
Según la directora del ISP, eso no es posible: «Si un producto tiene problemas, al final siempre lo vas a notar por una cosa o por otra».
Para la jefa de farmacia del Hospital San José, en cambio, el asunto es mucho más riesgoso con otros remedios, como los antibióticos, ya que no hay cómo medir su efectividad. La químico farmacéutica Elizabeth Romero explica que estos fármacos se prueban a través de «sensidiscos», un método que permite saber si los microorganismos que causan una infección reaccionan al antibiótico.
-Y claro, a través de ese método yo compruebo la eficacia del fármaco original, pero yo puedo estar usando una copia, un similar de marca, y con ése yo no logro nada. Lo pruebo (el método) con el original y al paciente lo trato con la copia -se lamenta Romero, pues sabe que los «sensidiscos» sólo existen para los medicamentos originales o de referencia y no para los genéricos.
Aún más difícil es el problema con las drogas oncológicas, dice la químico farmacéutica Verónica Rabanal, del Instituto del Cáncer, pues sus efectos se miden a muy largo plazo. La profesional no se siente respaldada por el ISP y cree que hace falta un ente regulador que obligue a hacer más pruebas sobre la efectividad de los productos.
Su colega del San José coincide con la necesidad de un cambio: «No hay una política de medicamentos que permita que usemos un producto que realmente sea seguro y efectivo frente al paciente. No lo tenemos. No es que el Instituto no haga nada, es que no tiene herramientas para hacerlo».
Como jefe de cardiocirugía en el Hospital San Juan, el doctor Eli Villalabeitia sabe lo sensible que es el uso del anticoagulante antes de entrar a pabellón. Por eso es duro a la hora de exigir que el que más necesita para operar, la heparina, sea de buena calidad.
«La heparina es un medicamento muy crítico en cirugía cardíaca. Tuvimos experiencias con laboratorios cuyas heparinas era muy malas», dice Villalabeitia. Para evitar problemas, sólo utiliza una marca, que sabe que es la que actúa en las dosis y tiempos esperados. Cuando en el hospital compran de otra, simplemente no opera. Así de sensible es el tema.
 La directora del ISP, Ingrid Heitmann, plantea que no es un problema de marca, sino que las últimas investigaciones han revelado que en los medicamentos de síntesis biológica, como la heparina o la insulina, la dosis está asociada a la marca. De hecho, actualmente el ISP trata a cada una como un producto nuevo y debe presentar sus propios estudios.
La directora del ISP, Ingrid Heitmann, plantea que no es un problema de marca, sino que las últimas investigaciones han revelado que en los medicamentos de síntesis biológica, como la heparina o la insulina, la dosis está asociada a la marca. De hecho, actualmente el ISP trata a cada una como un producto nuevo y debe presentar sus propios estudios.
-Lo que nosotros no podemos ver es si la dosis que tiene que usar es exactamente la misma que para otra marca. Eso es de responsabilidad del médico. Algo a lo que los médicos no estaban acostumbrados, porque antes los pocos productos biológicos que se producían eran los de marca y nada más- dice.
Pero Villalabeitia rebate ese argumento. Con 15 años como cirujano cardiaco, sabe perfectamente que hay variaciones de dosis, pero dice que cuando se superan los máximos recomendados hay riesgo de peligrosos efectos no deseados, como sangramiento excesivo. A su juicio, claramente hay un problema de calidad con las heparinas presentes en el mercado chileno.
-Esto es igual que la revisión técnica de los autos. Algunos no cumplen pero tienen certificados. A lo mejor hay dos que pasan la norma, pero eso no quiere decir que sean de la misma calidad. Lo mismo pasa con los medicamentos. Pasan la norma del ISP, pero sus calidades son muy distintas- asegura.
«Una droga genérica es igual a la ‘droga de nombre y marca’ en dosis, seguridad, intensidad, calidad, en la forma en que funciona, la forma en que es tomada y debe ser usada», señala la Food and Drug Administration (FDA), la agencia reguladora de los medicamentos en Estados Unidos. En Chile, ninguno de estos atributos puede ser endosado a los medicamentos genéricos. De hecho, para los puristas hablar de genéricos ya es una exageración. En estricto rigor no los hay, porque a diferencia de Estados Unidos, en Chile no existe una símil de la FDA que realice los tests que permitan comprobar que los medicamentos de referencia u originales, son iguales a sus genéricos o copias.
De acuerdo a las estadísticas, esa falencia ya comienza a ser un problema. De acuerdo a datos del International Marketing System o IMS Health -empresa internacional que audita datos de ventas- correspondientes al primer semestre de este año, sólo el 19,1% de los medicamentos consumidos en Chile son de marca, mientras que el 36,2% son clasificados como genéricos y el 44,7% como similares.
El presidente del Colegio Médico, Pablo Rodríguez, explica que a partir de 1967, el Laboratorio Chile -entonces estatal- empezó a producir el Formulario Nacional de Medicamentos, que no era otra cosa que medicamentos genéricos de buena calidad y a bajo precio. Por eso, dice Rodríguez, los doctores se acostumbraron a recetarlos y existe una cultura de genéricos más grande que en otros países. El escenario cambió cuando en los años 80 el Laboratorio Chile fue privatizado: «Hoy día vienen medicamentos de fuera, genéricos de mala calidad», asegura el dirigente gremial.
La directora del ISP reconoce que en Chile no hay equivalencia terapéutica certificada por ese organismo. Y ello porque aún no son obligatorios los exámenes de bioequivalencia: el análisis que mide que dos drogas con los mismos compuestos tengan una formulación que se comporte de la misma forma al ser consumido por una persona (los mismos tiempos y cantidades de absorción de la droga).
De allí que, cuando un profesional de la salud cambia un medicamento recetado por otro que en el papel tiene la misma fórmula, no puede garantizar que el efecto será el mismo.
-Si el producto tiene un perfil de concentración igual al de referencia, dices que es bioequivalente y por lo tanto puede ser intercambiable. Sin esos estudios, tú no puedes asegurar la intercambiabilidad. Ese es el problema -explica la académica de la Facultad de Ciencias Químicas y Farmacéuticas de la Universidad de Chile, Maria Nella Gai.
¿Y qué pasa si no son bioequivalentes? Gai nos lleva a los extremos iniciales: si la forma en que se aprovecha el medicamento es menor al producto de referencia, puede haber falta de efecto (el caramelo); si es mayor, puede haber problemas de toxicidad (el veneno). Todo depende del fármaco. «Sin los estudios, no puedes garantizar la eficacia y la seguridad», afirma Gai. Eficacia y seguridad son justamente dos de las exigencias que -junto a la calidad-, le impone la ley al ISP.
“Tuvimos experiencias con laboratorios cuyas heparinas era muy malas”, dice el jefe de cardiocirugía en el Hospital San Juan, doctor Eli Villalabeitia, al referirse al anticoagulante que necesita para operar. Explica que cuando se superan los máximos recomendados hay riesgo de peligrosos efectos no deseados, como sangramiento excesivo. Para evitar problemas, sólo utiliza una marca, que sabe que es la que actúa en las dosis y tiempos esperados. Cuando en el hospital compran de otra, simplemente no opera.
Además de no ser obligatorios los exámenes de bioequivalencia, sólo el medicamento de referencia debe presentar estudios clínicos para obtener un registro del ISP. Las copias o genérico que se registran después, se basan en los mismos estudios.
-El ISP autoriza y registra. Alemania tiene 4 ó 5 Omeprazol; Chile tiene 20, porque entra todo lo que llega. No se sigue ningún procedimiento, es como inscribir zapatos, lo dijo el Colegio Médico. El ISP permite cualquier cosa y después, si se mueren los viejos, reacciona. Eso no es normal -acusa el director del Centro de Investigaciones Farmacológicas y Toxicológicas de la Universidad de Chile, Iván Navarro, quien también dirigió el ISP.
Ingrid Heitmann conoce estas críticas que recaen sobre el ISP, pero replica que son cada vez menos reales. Respecto a los genéricos, explica que se exige el boletín analítico del producto, que demuestra características físicas, químicas, principio activo, disolución, estabilidad. Este boletín es el resultado de estudios hechos por un laboratorio acreditado por el ISP. Además, cada compañía debe guardar muestras de cada uno de sus lotes, los que son revisados por el instituto en caso de que se detecten problemas de calidad.
Y en cuanto a la bioequivalencia, la directora del ISP asegura que «cada vez estamos más cerca de que los estudios sean una realidad». En el papel, éstos se incluyeron en la normativa el 2005, pero su puesta en práctica se ha retrasado. Recién en mayo se publicó la resolución con los dos primeros medicamentos que se someterán a revisión, lo que abrió un nuevo flanco de críticas. Primero, porque a una tasa de dos productos al año, el avance es mínimo y en palabras de la misma doctora Heitmann, «terminaríamos el año del cuete».
Por eso la idea es que todos aquellos medicamentos cuyos fabricantes han hecho sus propios estudios de bioquivalencia o están certificados por otras agencias, sean reconocidos, lo que incentivaría la realización de estudios voluntarios. Así, el 2009 ya podrían encontrarse los primeros medicamentos con sello de bioequivalencia, luego de que se certifiquen los laboratorios que pueden hacer los tests. De todos modos el proceso será lento, pues los análisis se exigirán al renovarse el registro, lo que ocurre cada 5 años.
La otra crítica a este proceso es respecto a los dos primeros productos elegidos para ser analizados. Uno es un antiepiléptico; el otro, la clorfenamina, un antialérgico de uso común y sin ningún riesgo. La doctora Heitmann reconoce que la decisión no fue la más acertada, pero cree que al menos servirá para que la gente perciba el cambio, pues la clorfenamina es de consumo bastante masivo.
La realización de exámenes de bioequivalencia es un avance, pero para que tenga algún sentido debe garantizar que todos los medicamentos son fabricados bajo las mismas condiciones. Este requisito, a ojos de los expertos, aún está lejos de cumplirse en Chile.
El marco de referencia para poder garantizar la calidad de fabricación es la certificación de Buenas Prácticas de Manufactura (GMP por su sigla en inglés), un mecanismo impulsado por la Organización Mundial de la Salud (OMS) que, de acuerdo a la normativa chilena, debía cumplirse el 2002, pero que al igual que la bioequivalencia, se ha retrasado.
-Hace 5 años no se le podía pedir a la industria porque no lo tenían. Entonces, ¿nos íbamos a quedar de un día para otro sin medicamentos? Si tú le pides a la industria que de un año a otro haga todas las inversiones, los precios se te van a ir para arriba -argumenta la directora del ISP.
Además, los requisitos van aumentando. Por eso, según datos de Heitmann, hoy Chile tiene un nivel de cumplimiento del 95% de la guía anterior y de un 75% de la que se implementó el año pasado, lo que a su juicio es muy positivo.
 Lo que hacen las GMP es garantizar que los laboratorios cumplen los mejores estándares de calidad de fabricación y que lo hacen siempre, con lo cual se puede confiar que un lote de medicamentos fue producido en las mismas condiciones que otro. Es decir, si el lote A es bioequivalente con el medicamento de referencia, también debería serlo el lote B. Una máxima que hoy en Chile no necesariamente funciona.
Lo que hacen las GMP es garantizar que los laboratorios cumplen los mejores estándares de calidad de fabricación y que lo hacen siempre, con lo cual se puede confiar que un lote de medicamentos fue producido en las mismas condiciones que otro. Es decir, si el lote A es bioequivalente con el medicamento de referencia, también debería serlo el lote B. Una máxima que hoy en Chile no necesariamente funciona.
De acuerdo a la normativa actual, después de que el ISP aprueba el registro de un medicamento, el laboratorio no está obligado a mantener el mismo proveedor. Eso permite que en teoría alguien puede registrar un remedio producido en Estados Unidos o cuyos principios activos son traídos de Europa, pero luego, con la misma autorización, importar el producto desde un país asiático. Esto cambiará con un nuevo reglamento que actualmente tramita el ISP y que exige ligar el registro a una planta GMP específica.
En la actualidad no existe ninguna certeza de la calidad de los productores extranjeros. Esta preocupación comenzó hace pocos años con el explosivo crecimiento de las importaciones indias, aunque hoy, de acuerdo a estimaciones del ISP, el 40% de los medicamentos importados son fabricados en China.
En esto, dicen los expertos, se aplica una regla similar al resto de los productos del gigante asiático: en un mismo país se fabrican medicamentos y principios activos de altísima calidad, que de hecho son utilizados por los países desarrollados, así como también fármacos de pésimas condiciones. El problema es que no sabemos de cuáles estamos consumiendo.
-En Chile hay medicamentos de alta calidad, pero no podemos aseverar que todo lo que está presente en el mercado lo sea. No hay una calidad homogénea, principalmente en lo referente al producto importado de diversos orígenes, pues las plantas locales son auditadas constantemente. En países de la región, como Argentina, Brasil, Colombia y México, para otorgar el registro sanitario es necesario primero que la autoridad sanitaria visite las plantas para asegurarse que son GMP -afirma María Angélica Sánchez, vicepresidenta ejecutiva de la Asociación Industrial de Laboratorios Farmacéuticos (Asilfa, que reúne a los productores chilenos).
La crítica se repite entre distintos actores de la industria y es recogida por la directora del ISP, Ingrid Heitmann. Las visitas a plantas en el exterior ya empezaron con Hungría y Uruguay, países a los que seguirán El Salvador y China. Al gigante asiático se viajará para revisar laboratorios capaces de producir las vacunas contra la influenza para el próximo año. La idea es coordinar el trabajo con otras agencias de la región para sumar fuerzas.
Para cumplir su objetivo de preservar la calidad de los medicamentos, el ISP también cuenta con herramientas que operan una vez que los productos ya están en el mercado. La más importante es el control de estantería, que implica hacer estudios de laboratorio a los fármacos que ya entraron a la cadena de comercialización. No se trata de un control aleatorio: se elige tipos de productos que han tenido problemas o son sensibles por alguna razón.
De acuerdo a la normativa actual, después de que el ISP aprueba el registro de un medicamento, el laboratorio no está obligado a mantener el mismo proveedor. Eso permite que en teoría alguien puede registrar un remedio producido en Estados Unidos o cuyos principios activos son traídos de Europa, pero luego, con la misma autorización, importar el producto desde un país asiático.
Durante 2007 se analizó el 2% de los medicamentos comercializados (60 especialidades de 4.000 autorizadas). Según Ingrid Heitmann, los resultados están bajo el umbral considerado aceptable: se detectó un 5% de fármacos defectuosos. El dato cobra perspectiva cuando añade que cuando se iniciaron los controles de estantería, hace menos de una década, más del 15% de los remedios analizados tenía algún problema.
Pese al notable avance, muchos lo consideran insuficiente. José Manuel Cousiño, vicepresidente ejecutivo de la Cámara de la Industria Farmacéutica (CIF, reúne a los grandes laboratorios extranjeros), es de los que cree que la autoridad no está asegurando la calidad de los medicamentos. Su diagnóstico es que hay fallas regulatorias y que éstas podrían de alguna forma rectificarse con un buen control de estantería, lo que a su juicio no sucede.
«Con los resultados de los controles de estantería, el ISP infiere que la calidad de los medicamentos es adecuada. Y no es suficiente para afirmarlo. Para que esa muestra sea significativa tiene que ser representativa del mercado», opina la doctora Margarita Charlin, ex directora médica de Merck Sharpe & Dome. Hoy está a cargo de CTS (Clinical Trials Support) y como parte de un estudio, analizó los resultados de la siguiente etapa de control del ISP: los sumarios sanitarios, sistematizando la información pública incluida en 285 procesos sancionatorios.
Los datos entre 2004 y 2008 arrojan una clara diferencia entre BestPharma y el resto de los laboratorios. Sin contar sanciones por irregularidades como la publicidad o el etiquetado, los resultados de Charlín arrojan que el clausurado laboratorio tuvo 30 sanciones por calidad durante ese periodo. Muchísimo más atrás le sigue Laboratorio Chile con 8 casos, luego Sanderson (7), Recalcine (6) y Andrómaco, Biosano y Mintlan (4 cada uno).
Descontando BestPharma, su conclusión es que la mayoría de los problemas involucrados en los sumarios tiene que ver con productos inyectables, pues es más fácil detectar fallas de calidad, como ampollas que no se disuelven o elementos visibles en un líquido transparente. «Las cosas más finas no se detectan», enfatiza.
¿Se esconde entre todos ellos otro BestPharma? Al menos no hay casos tan flagrantes. El presidente del Colegio Médico, Pablo Rodríguez, es muy crítico a la normativa que regula el uso de medicamentos, pero a pesar de todo se atreve a decir que la calidad de éstos en Chile es buena con un argumento tranquilizador: «Chile tiene muy buenos indicadores sanitarios que fueron logrados con los medicamentos disponibles».
Entre octubre de 2002 y agosto de 2003, el laboratorio Best Pharma acumuló 17 sumarios sanitarios, lo que causó tal revuelo que provocó la constitución de una comisión Investigadora de la Cámara de Diputados. Los parlamentarios detectaron problemas regulatorios y de fiscalización, pero también concluyeron que era probable que las denuncias contra Best Pharma se debieran a la guerra comercial entre las empresas farmacéuticas, provocado por aquellas a las que el mencionado laboratorio les había quitado mercado, instalándose como principal proveedor del Estado.
El laboratorio tenía una estrategia de bajos precios que estaba desplazando a las compañías más tradicionales.
Eso fue el 2003. El año siguiente pareció darle la razón a los diputados, pues la compañía no recibió multas. Pero a partir de 2005, las cosas se complicaron con nuevos sumarios y también por el cierre de otros antiguos que tardaron demasiado en resolverse. En diciembre de ese año el laboratorio fue sancionado, entre otras cosas, porque se encontró un vidrio de 3,5 centímetros en la ampolla de un medicamento antibacteriano.
Entre las multas de 2006 estuvo la que gatilló la denuncia de Juan Esteban Mendoza cuando descubrió que dentro de la tira de antibióticos que había comprado había un insecto. El 2007 el hito fue el hilo negro encontrado en un frasco de ampicilina en el Hospital Padre Hurtado. Y este año comenzó con la multa por el pelo encontrado por los funcionarios del Hospital de Limache en un envase sellado.
Lo más grave vino en febrero, cuando se cerró el sumario por las fallas en la droga contra el cáncer de mama llamada Tamoxifeno. El medicamento -fabricado en China por el laboratorio Ningboo nº2- no sólo no estaba teniendo efectos terapéuticos, sino que además se descubrió que pertenecía a una serie cuyo registro sanitario había sido cancelado en agosto de 2004.
Tras el escándalo público, finalmente BestPharma bajó la cortina. Ya acumulaba 56 sumarios. Claramente no se trataba de una guerra comercial, como pensaban los diputados, sino de una empresa que reiteradamente puso en el mercado medicamentos con problemas de calidad.
¿Qué falló para que una empresa pudiera llegar a ese nivel de incumplimientos poniendo en riesgo la salud de la población? «Yo no creo que haya fallado nada«, es la respuesta de la directora del ISP, Ingrid Heitmann. Y agrega: «Si sorprendes a una persona con un papelillo de droga, no la puedes considerar traficante. Si la pillas con 2, tampoco. Tienes que ir viendo las sanciones que corresponde a su falta. Si lo descubres con un ladrillo, la metes presa por un año. Y con 40, por diez».
Heitmann cuenta que finalmente lo que gatilló el cierre del laboratorio fue la cantidad y magnitud de las faltas, pues tras las últimas irregularidades se hizo una revisión completa y se constató que tampoco habían cumplido con los requisitos que le había pedido el ISP. «Ahí dijimos basta», asegura la doctora. Consultada sobre si no habría podido evitarse los últimos 10 sumarios, nuevamente recurre a una figura para explicar que había que ganar antes pequeñas batallas y que a BestPharma se le cancelaron varios registros, algo que antes rara vez se hacía, por lo que este caso marcó un hito en el ISP.
-Tienes que juntar elementos de juicio. En este momento estamos con todas las reposiciones que está haciendo BestPharma. Nos va a llevar a juicio y contratarán a abogados defensores top porque hay mucho dinero involucrado, no van a contactar a cualquier perejil de por ahí. Finalmente, un juez tendrá que decidir. Nosotros tenemos que tener un caso hecho. ¿Te imaginas la vergüenza de que nos reviertan la sanción?- dice la directora del ISP para justificar la forma en que la institución manejó el caso BestPharma.