CIPER constató un mercado de productos sin regulación
Tráfico de tejidos humanos (3): Empresas del escándalo también venden en Chile
01.08.2012
Hoy nuestra principal fuente de financiamiento son nuestros socios. ¡ÚNETE a la Comunidad +CIPER!
CIPER constató un mercado de productos sin regulación
01.08.2012

Vea además:
Tráfico de tejidos humanos: cadáveres son el botín en una búsqueda global de ganancias
Tráfico de tejidos humanos II: Así cayó el cirujano dental de Brooklyn que lideraba una red internacional de partes del cuerpo
Gran impacto provocó la investigación del Consorcio de Periodistas de Investigación de Estados Unidos (ICIJ) que develó una red de tráfico ilegal en la industria de productos médicos que obtiene ganancias convirtiendo restos mortales en implantes dentales, cintas uretrales o tratamientos para arrugas. Grandes compañías, como RTI Biologics, LifeCell Corporation y el banco de tejido Musculosketal Transplant Foundation, aparecen involucradas en el escándalo que incluía robo de cadáveres en Ucrania y en Estados Unidos, donde el rol protagónico lo tenía un cirujano dental de Brooklyn (Vea las investigaciones de ICIJ: TRÁFICO DE TEJIDOS I y TRÁFICO DE TEJIDOS HUMANOS II).
Los pabellones quirúrgicos y clínicas dentales chilenos no son ajenos a la realidad del negocio de tejidos humanos que mueve millones de dólares en todo el mundo. CIPER investigó los vínculos locales de estas empresas y no sólo descubrió registros de importaciones que muestran que sus redes de distribución llegan a este país, sino también la ausencia de control de las autoridades de salud sobre el floreciente mercado de tejidos.
Como en nuestro país no hay empresas que produzcan biomateriales o tejidos humanos manufacturados, básicamente debido a que son procesos altamente complejos, el abastecimiento se hace a través de la importación, siendo Estados Unidos uno de los mayores proveedores.
Por sus altos costos, el uso de estos materiales en Chile se hace fundamentalmente en el sistema privado de salud. Si bien en la industria internacional de tejidos biológicos las materias primas -las partes de cadáveres- son adquiridas a través de donaciones (debido a la prohibición de venta directa de tejidos u órganos), sí se mueven grandes sumas de dinero en un proceso que abarca desde costos por hallazgo, recuperación, almacenamiento y tecnología con que se procesan los tejidos.
En Chile hoy se importan desde sustitutos óseos para tratamientos dentales, hasta ligamentos o tendones de cadáveres para un negocio que cuenta con escasa regulación y ninguna fiscalización sanitaria.
 Los productos de las industrias involucradas en la red de tráfico de tejido humano investigadas por ICIJ (RTI Biologics, LifeCell y el banco de tejido MTF), llegan a Chile a través de representantes oficiales y empresas importadoras especializadas. Una de las compañías con mayor alcance en el comercio de implantes dentales y sustitutos óseos, es la Comercializadora Biomateriales Ltda., representante oficial de Zimmer Dental, empresa proveída por RTI Biologics de los productos de tejido y huesos de origen humano y bovino.
Los productos de las industrias involucradas en la red de tráfico de tejido humano investigadas por ICIJ (RTI Biologics, LifeCell y el banco de tejido MTF), llegan a Chile a través de representantes oficiales y empresas importadoras especializadas. Una de las compañías con mayor alcance en el comercio de implantes dentales y sustitutos óseos, es la Comercializadora Biomateriales Ltda., representante oficial de Zimmer Dental, empresa proveída por RTI Biologics de los productos de tejido y huesos de origen humano y bovino.
El principal producto distribuido por Biomateriales Ltda. son los injertos de huesos humanos Puros que, en formato de polvo o masilla, son utilizados usualmente como sustitutos óseos para tratamientos dentales.
También se encuentra una filial de Biohorizons, empresa multinacional que entre su oferta en el área dental comercializa productos de origen biológico de LifeCell Corporation. Uno de ellos es AlloDerm: una membrana de dermis de cadáver utilizada para la reconstrucción de encías y otros tratamientos que requieren apósitos de tejido en caso de quemaduras o cirugías estéticas.
Importadora Hélico Ltda., en un rubro más amplio, comercializa productos para diversas especialidades médicas que van desde productos para tratamiento de columna hasta neurocirugía, las que ellos definen como sus “áreas de negocio”. Respecto de productos de origen humano, Hélico encarga tejidos para uso traumatológico. Según guías de importación y exportación, la empresa ha importado, por ejemplo, un tendón de Aquiles humano procesado por RTI Biologics por una suma que supera los US$ 6 mil.
Las gerentes de Biomateriales Ltda. y Biohorizons, al ser consultadas por CIPER por los procedimientos de compra, volúmenes de importación y marcos regulatorios de su negocio, se negaron a acceder a una entrevista. Importadora Hélico, a través de su encargada de Marketing, informó que no estaban interesados en ser parte de esta publicación.
Tanto Biomateriales Ltda. como Biohorizons informan a través de sus sitios web que sus certificaciones vienen desde Estados Unidos. Es decir, se rigen por algunas normas ISO y por la FDA (US. Food and Drug Administration), institución que según la investigación de ICIJ no desarrolla un proceso estricto para el registro de bancos de tejido, no verifica en todos los casos si existe el consentimiento legal de las familias de los donantes y ha retirado entre 1994 y mediados de 2007 más de 60 mil productos derivados de tejidos humanos ante el riesgo de transmisión de enfermedades.
 Aun así, los profesionales del área odontológica nacional confían en estas certificaciones. El presidente del Colegio de Cirujanos Dentistas de Chile, doctor Roberto Irribarra, señala que la certificación de la FDA o de la Comunidad Económica Europea son garantías de seguridad en el caso de implantes médicos o sustitutos óseos, ya que no existen certificaciones nacionales que realicen un control similar:
Aun así, los profesionales del área odontológica nacional confían en estas certificaciones. El presidente del Colegio de Cirujanos Dentistas de Chile, doctor Roberto Irribarra, señala que la certificación de la FDA o de la Comunidad Económica Europea son garantías de seguridad en el caso de implantes médicos o sustitutos óseos, ya que no existen certificaciones nacionales que realicen un control similar:
-El que nosotros tuviéramos un sistema de evaluación de nuestros productos sería fantástico, pero esto significa mayores trabas a la importación de estos elementos y más encarecimiento. Probablemente esa es una de las razones por las cuales no hay una mayor regulación, pero no significa que no sea deseable tenerla –explica Irribarra.
Es difícil dimensionar el tamaño del mercado de los productos médicos de origen biológico (humano o bovino) en Chile, ya que el detalle del registro de venta de biomateriales solo se encuentra en manos de los proveedores. Estas empresas importan sus mercancías a través de agentes aduaneros, e ingresan sus productos a través de la denominación “lo demás” en la nómina de importación de “instrumentos y aparatos de medicina y cirugía”; “glándulas y demás órganos para uso opoterápicos”; y “artículos y aparatos de prótesis para ortopedia” (según la clasificación de códigos de Aduana).
Así, todos los biomateriales, tejidos para alo injertos (de tejido humano), membranas dérmicas y otros productos que ingresan como “lo demás” frente a las categorías antes descritas, participan de un mercado de importaciones que según cifras del Servicio Nacional de Aduanas sumó cerca de US$ 33 millones entre enero y junio de 2012 (ver tabla). En tanto, solo la multinacional estadounidense RTI Biologics en 2011, según confirma ICIJ, obtuvo US$ 11, 6 millones en ganancias previas al pago de impuestos.
 El doctor Daniel Farías, presidente de la Sociedad de Implantología Oral de Chile, confirma que continuamente se presentan ante las sociedades de especialistas nuevos distribuidores de productos para el área biomédica –tanto naturales como artificiales- que no cumplen ni siquiera con estándares internacionales:
El doctor Daniel Farías, presidente de la Sociedad de Implantología Oral de Chile, confirma que continuamente se presentan ante las sociedades de especialistas nuevos distribuidores de productos para el área biomédica –tanto naturales como artificiales- que no cumplen ni siquiera con estándares internacionales:
“Hoy está plagado de este tipo de empresas aquí y en el mundo. La industria es muy atractiva en términos de mercado y de demanda, entonces hay que tener mucho cuidado”, dice el especialista, quien atribuye este problema a una falta de regulación de los organismos fiscalizadores del Estado.
-Yo creo que corresponde a una responsabilidad compartida entre las autoridades de salud, el Instituto de Salud Pública y el Ministerio de Salud. Efectivamente, a lo mejor tendrían que poner criterios más estrictos para permitir la comercialización, porque tengo la impresión de que en Chile no es tan complejo como en otros países comercializar estos productos. Por eso es que muchas empresas están utilizando a Chile como plataforma para Latinoamérica -afirma Farías.
Y es en este punto donde el presidente de la Sociedad de Implantología Oral afirma que un rol clave deberían jugar las investigaciones de las universidades chilenas para el testeo de los productos, el que debiera complementarse con la exigencia de documentos científicos o publicaciones internacionales que avalen los sellos de calidad con que llegan los materiales de origen biológico.
Cualquiera que desee entrar en Chile al negocio de los biomateriales, derivados de huesos o tejidos humanos como piel, ligamentos o tendones de muertos, hoy cuenta con grandes facilidades para su importación y comercialización debido al vacío que existe en la legislación que regula este tipo de productos. Según información entregada por el Instituto de Salud Pública, en Chile la normativa sanitaria no contempla la figura de biomateriales, y si bien estos serían considerados como un tipo particular de dispositivo médico de origen biológico, no existe ningún documento que dé cuenta de su consideración dentro de la normativa vigente.
 El Código Sanitario establece que productos como medicamentos y cosméticos deben ser sometidos obligatoriamente a un registro y exhaustivo análisis de componentes antes de su salida al mercado. La regulación de dispositivos médicos no opera de la misma forma. Actualmente solo se someten a control cinco tipos de dispositivos médicos que deben ser aprobados por empresas de certificación acreditadas (ver recuadro). Ante el vacío legal de los biomateriales, las empresas que los distribuyen solo se registran ante el ISP de forma voluntaria, e inscriben sus productos llenando un formulario que incluye aspectos como la certificación del país de origen y listado de componentes.
El Código Sanitario establece que productos como medicamentos y cosméticos deben ser sometidos obligatoriamente a un registro y exhaustivo análisis de componentes antes de su salida al mercado. La regulación de dispositivos médicos no opera de la misma forma. Actualmente solo se someten a control cinco tipos de dispositivos médicos que deben ser aprobados por empresas de certificación acreditadas (ver recuadro). Ante el vacío legal de los biomateriales, las empresas que los distribuyen solo se registran ante el ISP de forma voluntaria, e inscriben sus productos llenando un formulario que incluye aspectos como la certificación del país de origen y listado de componentes.
No hay control directo, análisis químico, ni norma técnica para los productos cuya materia prima es piel u osamentas de cadáver.
Ante las consultas de CIPER por la falta de claridad en la clasificación y regulación de biomateriales de uso médico, el Instituto de Salud Pública se negó a entregar su versión aduciendo a que tanto la directora como la subdirectora de la institución se encontraban fuera del país. Lo mismo hizo el Ministerio de Salud, cuyo departamento de Comunicaciones informó que no se referirían al tema, luego de una solicitud de entrevista al subsecretario de Salud Pública con el fin de aclarar los esfuerzos por regular la importación de materiales de tejidos biológicos y uso de los productos en Chile.
Las prácticas de obtención de tejido humano por las empresas de biomateriales han levantado alarma por los riesgos asociados al contagio de enfermedades. La investigación de ICIJ dio cuenta de la inexistencia de mecanismos de seguimiento efectivo a todos los tejidos que llegan a estas compañías, a diferencia de lo que ocurre con las normativas de donación de órganos a nivel internacional para prevenir infecciones que se puedan transmitir desde los donantes a los pacientes receptores de tejido.
Ese vacío ubica en un lugar preponderante el manejo ético y profesional de los médicos que administran estos productos a sus pacientes.
Cualquiera que se someta a un procedimiento médico tendrá riesgos asociados a este. En el caso de los biomateriales, el consentimiento informado del paciente debe contemplar la información de las posibles complicaciones y de cuál es la procedencia de los productos. Es decir, el doctor responsable debe dejar en claro que lo que se utiliza son tejidos y huesos de cadáver humano o bovino.
Por otro lado, según explican los profesionales del área, también es un deber llevar minuciosamente los datos de la ficha médica de cada paciente. En el caso de los dispositivos médicos, y particularmente en el caso de los de origen biológico, debe existir un código de serie que pueda registrarse en la ficha del paciente y poder consultar por él ante los distribuidores en caso de existir cualquier complicación.
De solo un donante de tejido se pueden extraer cerca de 5 mil centímetros cuadrados de material. Los restos óseos se usan principalmente para relleno de cavidades, por ejemplo, en operaciones de cadera. Cada centímetro de piel es invaluable para los especialistas que tratan cirugías reconstructivas y heridas en personas quemadas, ya que son utilizados como cobertura transitoria mientras el paciente logra generar tejido propio. Debido al alto costo de membranas dérmicas de cadáver importadas desde el extranjero, en Chile es más común utilizar para estos efectos tejidos artificiales. Esto, ante el poco conocimiento y vacío legal en la ley de donación de órganos.
Según explica la doctora Teresa de la Cerda, presidenta de la Sociedad Chilena de Cirugía Plástica, Estética y Reconstructiva; hoy los médicos no tienen libertad de acudir a bancos de tejidos biológicos como ocurre en otros países. Por esta razón, se importan productos de origen humano, bovino o artificial que son muy costosos, más aun para el sistema público de salud.
 -Lo que pasa es que los tejidos (de chilenos donantes) no están tan disponibles, no es fácil, pero la gente que trabaja en grandes quemados las ocupa y con extraordinario rendimiento. Con todos los problemas para donar un órgano que es vital, imagine lo que es la piel, que es el órgano más grande del cuerpo. Somos poco evolucionados en esto todavía -afirma Teresa de la Cerda.
-Lo que pasa es que los tejidos (de chilenos donantes) no están tan disponibles, no es fácil, pero la gente que trabaja en grandes quemados las ocupa y con extraordinario rendimiento. Con todos los problemas para donar un órgano que es vital, imagine lo que es la piel, que es el órgano más grande del cuerpo. Somos poco evolucionados en esto todavía -afirma Teresa de la Cerda.
El doctor Jorge Villegas, jefe de la Unidad de Quemados de la Posta Central y la Clínica Indisa, confirma que la dificultad para conseguir tejidos para el tratamiento de heridas se debe a un vacío en la legislación actual:
-La donación de tejidos es mucho más compleja. Primero, porque no está catalogada como órgano. Esto hay que instalarlo como tema. Debería estar enmarcada de igual manera que el resto de las donaciones. El segundo aspecto, es uno operacional, porque desarrollar equipos de procuramiento ha sido extraordinariamente complejo.
Los equipos de procuración son los médicos encargados de extraer los órganos o tejidos ante el aviso de un donante potencial. Actualmente estos procedimientos no cuentan con financiamiento de FONASA, lo que genera otra traba para la extracción de tejidos destinados a los servicios públicos.
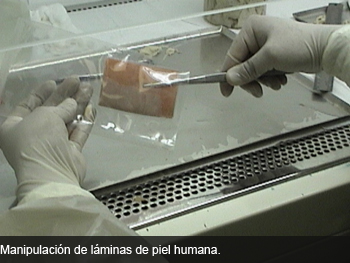
En Chile existe solo un lugar que procesa tejidos humanos para abastecer la demanda por piel o injertos óseos en algunos hospitales públicos. El Laboratorio de Procesamiento de Tejidos Biológicos de la Comisión Chilena de Energía Nuclear (CCHEN), es donde se esterilizan las escasas donaciones de piel, huesos y membranas amnióticas que existen en Chile desde 2000.
-Es una necesidad. Antes, en Chile todo se importaba, pero los costos eran tremendos. Como los hospitales públicos no tenían acceso, muchas veces utilizaban piel de cerdo tratada con antibióticos para los grandes quemados. También se usaba piel humana de donante solidario lo que también es costoso porque significa contar con dos pacientes -explica Paulina Aguirre, jefa de la Sección de Salud y Alimentos de la CCHEN.
 Es así como el laboratorio de procesamiento de tejidos funciona como un paso intermedio que esteriliza los tejidos de los hospitales asociados que hoy incluyen principalmente la Posta Central y los hospitales Exequiel González Cortés, Roberto del Río, Luis Calvo Mackenna y el Hospital Guillermo Grantt de Concepción. Así, ante el repentino aviso de un posible donante, se convoca a los equipos de procuración de las distintas áreas, siendo los que extraen tejido los últimos en la cadena de donación.
Es así como el laboratorio de procesamiento de tejidos funciona como un paso intermedio que esteriliza los tejidos de los hospitales asociados que hoy incluyen principalmente la Posta Central y los hospitales Exequiel González Cortés, Roberto del Río, Luis Calvo Mackenna y el Hospital Guillermo Grantt de Concepción. Así, ante el repentino aviso de un posible donante, se convoca a los equipos de procuración de las distintas áreas, siendo los que extraen tejido los últimos en la cadena de donación.
-Todo esto tiene que ser muy rápido porque la familia requiere el cuerpo de su familiar para sepultarlo. La gente cree que por donar piel, el cadáver va a quedar desollado, pero cuando se saca la piel es una capa muy delgada que no sangra por el estado del cuerpo -explica Paulina Aguirre, en referencia al desconocimiento cultural sobre este tipo de donación.
Luego de que los tejidos obtenidos de la piel son dispuestos en láminas, son enviados de inmediato al laboratorio, donde luego de ser empacados en sobres individuales serán refrigerados antes de la esterilización por radiación. El ciclo termina cuando los tejidos retornan a los hospitales de procedencia.
La labor del laboratorio es vital para eliminar los riesgos infecciosos de los tejidos donados y la posibilidad de rechazo de injertos. Es por ello que como requisito básico exigen los exámenes de VIH, VDRL y Hepatitis B y C desde los centros de procuración. De todas formas, Paulina Aguirre explica que una de las principales preocupaciones son las exigencias de “trazabilidad”: el seguimiento que se hace de los datos del donante para fichar el tejido, hasta el paciente de destino.
Además de los vacíos en la ley de donación de órganos respecto a la piel o huesos, en Chile no existe ninguna ley que regule a los bancos de tejidos. Las normativas adoptadas por el centro de procesamiento de tejidos son las que regulan al Organismo Internacional de Energía Atómica (OIEA), entidad que ha habilitado al centro de la Comisión Chilena de Energía Nuclear de equipamiento y capacitación para sus funcionarios.
Luego de la modificación de la Ley de Transplantes en 2011, se dio origen a la Coordinadora Nacional de Transplantes, entidad que funciona al interior del Ministerio de Salud y se encuentra trabajando para mejorar las políticas públicas para la donación. Si bien las cifras han aumentado este último año, la donación de tejido por lejos sigue siendo poco frecuente para la realidad nacional. Este año ha habido a la fecha siete donantes de piel humana. En 2011 hubo solo cuatro.
Por Decreto Supremo del Ministerio de Salud, son cinco los dispositivos médicos sometidos a control obligatorio ante las empresas de certificación: los guantes de examinación, guantes quirúrgicos, preservativos, agujas y jeringas hipodérmicas.
Según el Instituto de Salud Pública, sus responsabilidades respecto a estos productos a través de la Sección de Dispositivos Médicos, del Subdepartamento de Seguridad del Departamento de Control Nacional, son:
• Autorizar y fiscalizar a los Organismos Certificadores de productos que se encuentren bajo control obligatorio.
• Inscribir los productos que se encuentran bajo control obligatorio previo a la comercialización.
• Autorizar el uso y disposición de los dispositivos médicos bajo control obligatorio.
• Inscribir empresas fabricantes/distribuidoras de dispositivos médicos y la lista de los dispositivos médicos que comercializan.
• Gestionar la evaluación técnica de algunos dispositivos médicos in vitro (reactivos de diagnóstico).
• Mantener un sistema de Vigilancia post-comercialización de Dispositivos Médicos (Tecnovigilancia), evaluando las notificaciones recibidas por parte de los usuarios como de los fabricantes/distribuidores. Se debe notificar todo comportamiento defectuoso, falla o deterioro que los dispositivos médicos presenten antes, durante o después de su uso.
• Proponer al Ministerio de Salud los productos que serán sometidos a control obligatorio.*Fuente: web Instituto de Salud Pública de Chile
Según la investigación realizada por CIPER, ni las empresas ni los productos considerados dentro de la industria de dispositivos médicos de origen biológico o biomateriales (tejidos alo injertos, membranas dérmicas, sustitutos óseos, etc.), son considerados dentro de las responsabilidades del ISP antes descritas, al no figurar dentro de los dispositivos de control obligatorio. El único marco regulatorio es la posibilidad de inscripción voluntaria de empresas y productos ante el organismo correspondiente.